7月4日,我院动物多肽药物创制国家地方联合工程实验室刘中华教授团队张鹏博士以第一作者在国际著名期刊《Advanced Science》发表了最新研究成果“A Lipid-Sensitive Spider Peptide Toxin Exhibits Selective Anti-Leukemia Efficacy through Multimodal Mechanisms”。Advanced Science是由Wiley出版的国际顶级期刊,中科院一区TOP期刊,2023年影响因子14.3。
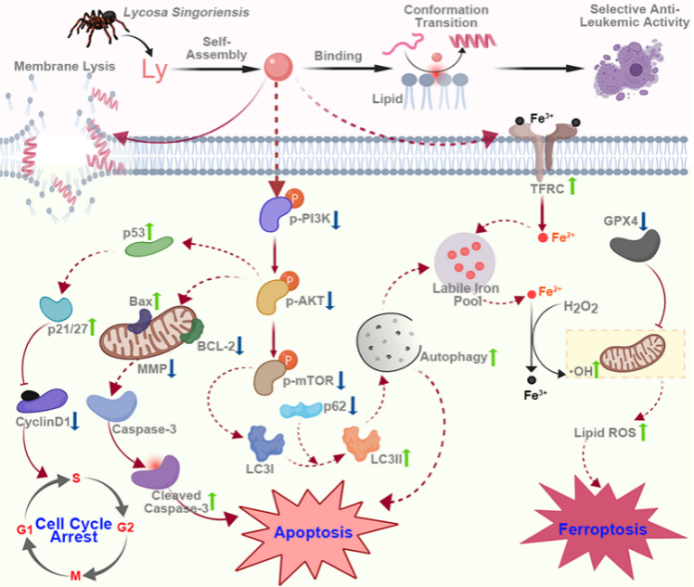
动物毒液是极具特色的天然产物,蕴藏着多种抗癌肽(Anticancer Peptides, ACPs)。其作用迅速而不易产生耐药性,是研发抗癌药物的重要资源,然而ACPs的系统性作用机制,特别是新的机制仍有待阐明,这对推进其在癌症治疗中的应用具有重要意义。本研究以分离于新疆穴居狼蛛(Lycosa singorensis)毒液中的抗癌肽Lycosin-I为对象,发现其对白血病细胞系和临床分离白血病细胞株具有强作用活性而对正常细胞和实体瘤细胞活性弱,具有较好的选择性抗癌活性。Lycosin-I能够选择性与膜磷脂中的磷脂酰丝氨酸结合,二级结构由无规则卷曲转换为α-螺旋发挥抗白血病活性。进一步研究表明以多模式作用机制发挥抗癌活性:在高浓度下Lycosin-I能够快速诱导白血病细胞系K562细胞膜裂解。在低浓度下Lycosin-I能够下调AKT-PI3K-mTOR信号通路诱导细胞自噬、凋亡、周期阻滞和铁死亡。(1)通过线粒体凋亡途径激活caspase-3诱发细胞凋亡;(2)上调p21、p27和p53导致Cyclin D1/E1下调引发细胞周期阻滞;(3)增加转铁蛋白的表达,提高细胞内Fe2+水平,降低GPX4的表达,导致铁稳态破坏和脂质过氧化诱发铁凋亡;(4)上调LC3-II/LC3-I并且下调p62诱导细胞自噬,自噬增加又进一步增强了细胞凋亡和铁死亡。体内实验表明Lycosin-I能够显著抑制K562肿瘤体积且无明显毒副作用。本研究首次发现ACPs可诱导肿瘤细胞铁死亡,极大加深了对ACPs的作用机制的认识;同时Lycosin-I的多模式作用机制可有效的应对白血病治疗中的耐药性问题,因而可作为一个用于白血病治疗的药物先导分子,具有重要开发价值。
张鹏博士一直从事抗癌/抗菌毒素多肽优化设计及作用机制研究,系列研究成果以第一作者/通讯作者在JACS、Theranostics、Nano Res发表论文15篇,其中IF>10论文4篇,获国家和省部级项目5项,入选省优秀博士后创新人才,主持的多肽设计技术被遴选为湖南省十大颠覆性技术。
该研究论文以我校为第一署名单位,张鹏博士、湖南大学罗武博士后和丁小凤教授课题组张梓欣为共同第一作者。湖南大学罗武博士后、南方医科大学第三附属医院易彦教授、丁小凤教授和刘中华教授为通讯作者。本研究得到了国家自然科学基金青年/面上基金、芙蓉实验室科技攻关项目、省颠覆性技术项目、省人才计划和湖南师大交叉学科经费支持。
(文章链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202404937 )


